炎症与肿瘤之间的联系在很早之前就已经被建立起来,大量的研究证据显示,炎性环境会促进肿瘤的发生发展【1】,但是这背后的分子机制却一直没有被完全阐释清楚。其中,胰腺导管癌 (PDAC) 就是炎症和原癌基因协同作用的一个经典范例:多项研究结论表明,在携带KRAS突变的胰腺组织中诱导炎症不仅反应会加速肿瘤的进展,胰腺的炎症反应还会诱发腺泡导管化生 (as acinar-to-ductal metaplasia, ADM) 和胰腺上皮内瘤变 (pancreatic intraepithelial neoplasia, PanIN) 等肿瘤早期病变,而这些早期病变则会慢慢进展成恶性肿瘤。尽管,最近的一些研究证据显示炎症介导的染色质重塑可能会在这一过程中扮演关键角色【2】,但是这其中的具体分子机制却并未研究透彻。
近日,来自德克萨斯大学安德森癌症中心的Andrea Viale研究团队在Science上发表了题为Epithelial memory of inflammation limits tissue damage while promoting pancreatic tumorigenesis的研究文章,揭示了炎症反应和原癌基因KRAS突变通过对胰腺上皮细胞进行表观重塑进而导致PDAC发生的具体分子机制。

为了探究炎症对于胰腺上皮细胞转化的影响,作者在PDAC小鼠 (用四环素诱导KRASG12D胰腺特异性表达) 模型中用CAE (一种肠促胰酶肽类似物) 来诱导胰腺的组织损伤和瞬时的炎症反应(图1A),他们发现CAE处理小鼠体内的肿瘤负荷显著增加且生存期大幅降低(图1C)。更加有意思的是,他们发现即使是在CAE处理的3个月后 (CAE诱导的组织损伤约在28天左右恢复正常) 再去诱导KRASG12D的表达也依然观察到了类似的实验现象。这说明即使是瞬时的炎症反应也具有一个长期的效应,并会与原癌基因KRAS协同促进正常上皮细胞向肿瘤的转变。
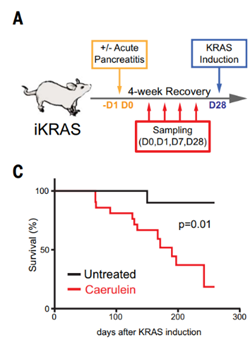
图1. 动物实验设计示意图
进一步,体外的3D细胞培养实验则证实炎症反应与原癌信号驱动的上皮细胞转变是以一种细胞自主的方式进行,并非由于微环境的改变所致。为了弄清楚炎症的长期效应是如何驱动肿瘤的进展,作者将经CAE处理不同时间(Day 1, 7, 28)的小鼠胰腺组织进行了单细胞测序分析,他们发现腺泡细胞在炎症发生后会很快(Day 1)产生转录组学变化,例如腺泡消化酶表达下降和导管标记物表达升高,而这些改变与ADM的分子表型是一致的。除了这些瞬时的改变,CAE处理7天和28天的小鼠的肺泡细胞的增殖分化、胰腺胚胎发育与肿瘤发生等通路会显著激活。这说明正常的胰腺上皮细胞从瞬时的炎症反应中恢复后,它们会通过转录和表观遗传重编程来获得持续适应性反应,并且作者还证明这些发生表观重塑的胰腺上皮细胞来源于DCLK1阳性的祖细胞。
为了更好地在分子层面理解炎症是如何驱动KRAS突变介导的上皮细胞癌变,作者将研究的目光聚焦在了EGR1——一个调控组织再生的转录因子,因为作者注意到EGR1在所有的组学分析中是参与细胞重编程的最显著的转录因子之一。通过构建Egr1-/- PDAC小鼠模型,作者证明EGR1在胰腺肿瘤发生和炎症诱导的上皮细胞重编程中起着关键作用。那么究竟是哪一种免疫细胞和炎症因子参与了上皮细胞的重编程?通过体外和体内的实验,作者发现IL-6是其中起主要作用的细胞因子,而巨噬细胞则是IL-6主要来源。
由于上皮细胞对炎症的记忆功能的“初衷”是去提升器官对于损伤的适应能力,那么这一过程又是如何导致了肿瘤的发生呢?为了探讨炎症驱动的上皮细胞重编程与肿瘤发生的内在逻辑关系,作者对CAE-损伤恢复的PDAC小鼠进行了再次CAE处理,作者发现ADM的发生的确会促进机体对于炎症损伤的抵御能力。因此,作者推测基于正向的进化压力,由KRAS等原癌基因突变所致MAPK信号通路激活对于机体抵御二次损伤可能是有益的,小鼠实验也的确证实了这一猜想,然而,这一过程同样会使得ADM变得不可逆,进而导致肿瘤的发生。
值得一提的是,同期Science杂志还发表了另外一篇研究文章从另一个不同的角度来揭示炎症与肿瘤发生发展的关系【3】。基于此,Science杂志社邀请了来自约翰霍普金斯大学肿瘤科的Won Jin Ho和Laura D. Wood教授发表了题为Opposing roles of the immune system in tumors的评述文章。在评述中,两位教授认为这两篇同期发表的文章为我们理解免疫系统如何驱动肿瘤发生的分子改变提供了深远的概念创新(“provide far-reaching conceptual innovations in our understanding of how the immune system drives molecular alterations in tumor cells”),同时他们也指出本篇研究的局限性:该研究所用到的基因操作和处理时间只有在小鼠模型中才可能实现,因此这些发现与人类胰腺肿瘤发生的相关性仍需要进一步的实验验证。
参考文献
1. A. Mantovani, P. Allavena, A. Sica, F. Balkwill, Cancer-related inflammation. Nature 454, 436–444 (2008).
2. D. Alonso-Curbelo et al., A gene-environment-induced epigenetic program initiates tumorigenesis. Nature 590, 642–648 (2021)
3. T. D. Martin et al., Science 373, 1327 (2021)













